- Главная
Экологический кризис прибрежной зоны. Тезисы Верищагинской конференции
Limnological Institute of the Siberian Branch of the Russian Academy of Sciences
Федеральное государственное бюджетное учреждение науки
Лимнологический институт Сибирского отделения Российской академии наук
Baikal Museum of the Irkutsk Scientific Centre, Siberian Branch of the Russian Academy of Sciences
Федеральное государственное бюджетное учреждение науки Байкальский музей
Иркутского научного центра Сибирского отделения Российской академии наук
Molchanov-Sibirsky Irkutsk Regional State Multipurpose Scientific Library
Иркутская областная государственная универсальная научная библиотека
имени И.И. Молчанова-Сибирского
6TH INTERNATIONAL VERESHCHAGIN BAIKAL CONFERENCE
ШЕСТАЯ МЕЖДУНАРОДНАЯ ВЕРЕЩАГИНСКАЯ БАЙКАЛЬСКАЯ
КОНФЕРЕНЦИЯ
4TH BAIKAL SYMPOSIUM ON MICROBIOLOGY(BSM-2015)
MICROORGANISMS AND VIRUSES IN AQUA TIC ECOSYSTEMS
4-Й БАЙКАЛЬСКИЙ МИКРОБИОЛОГИЧЕСКИЙ
СИМПОЗИУМ С МЕЖДУНАРОДНЫМ УЧАСТИЕМ «МИКРООРГАНИЗМЫ И
ВИРУСЫ В ВОДНЫХ ЭКОСИСТЕМАХ»
SEPTEMBER 7-12, 2015
7-12 СЕНТЯБРЯ, 2015
ABSTRACTS
ТЕЗИСЫ ДОКЛАДОВ И СТЕНДОВЫХ СООБЩЕНИЙ
IRKUTSK, 2015
ИРКУТСК, 2015
bacteria. Another specific consortium has been found in bitumen mounds at the natural oil seep Gorevoy Utes in Central Baikal. Aquatic fungi of the genus Phytium, archaea, bacteria, including methanotrophic bacteria, nematodes, and ostracods, were identified in the consortium. It is supposed that the mycelium of aquatic fungi ingrowing the bitumen favors transportation of microorganisms into the bitumen. These organisms use different hydrocarbons as a substrate, thus providing access of oxygen into deep layers of bitumen. Hydrocarbon oxidizing bacteria may serve as food for nematodes and other organisms for their existence inside bitumen mounds.
The work was supported by the RAS Presidium Program 23.8 and RFBR project 14-44-04126.
БЕНТОСНЫЕ СООБЩЕСТВА ГЛУБОКОВОДНОЙ ЗОНЫ ОЗЕРА
БАЙКАЛ: СТРУКТУРА И ФУНКЦИОНИРОВАНИЕ
Ситникова Т.Я. , Погодаева Т.В. , Хлыстов О.М. , Калмычков Г.В. , Механикова И.В., Земская Т.И.
1 Лимнологический институт СО РАН, Иркутск, Россия
2 Институт геохимии СО РАН им. А.П. Виноградова, Иркутск, Россия
Озеро Байкал характеризуется наличием разнообразных геологических структур на дне, приуроченных к зонам разломов. В последние годы при помощи средств многолучевой эхолокации, батиметрической съемки в сочетании с сейсмическими данными и данными сонара бокового обзора, закартированы и описаны новые районы, в которых происходит выброс флюидов и/или грязевулканической брекчии и обнаружены залежи гидратов метана (Khlystov et al., 2013). Во всех этих районах отмечены разгрузка метана в водную толщу и поступление химических соединений, которые могут служить дополнительными источниками энергии и органического углерода для бентосных сообществ озера Байкал. В районах метановых сипов и грязевых вулканов развиваются бентосные сообщества, жизнедеятельность которых основана на углеводородах, поступающих из донных осадков (Zemskaya et al., 2012, 2015). В районах с аномальным составом поровых вод плотность поселения мейо- и макробентоса в 1.5-10 раз выше по сравнению с фоновыми районами. Для животных организмов глубинной зоны озера отмечены разнообразные пищевые стратегии, обеспечивающие существование огромного количества эндемичных видов, так отличающего Байкал от других пресноводных экосистем. На основе анализа значений стабильных изотопов углерода и азота в тканях животных установлено, что их жизнедеятельность основана на хемо- (метано-), фото-, и миксотрофии. Ярким примером существования биологических сообществ за счет использования углерода метана являются желеобразные микробные маты, формирующиеся над слоями газогидратов в районе метанового сипа Санкт-Петербург (Средний Байкал). Концентрация ионов хлора, брома, сульфата, ацетата, кальция, магния, железа в микробных матах была в 2-40 раз выше по сравнению с поровой водой из поверхностных осадков и с придонной водой. Высокое содержание Сорг. в матах (до 6%) и облегченный изотопный состав углерода бентосных животных из данного района свидетельствуют о значимой роли углерода метана, который поступает из донных осадков и вовлекается в круговорот метанотрофными бактериями. Еще один своеобразный консорциум отмечен при исследовании битумных построек в районе естественного нефтепроявления Горевой Утес в Среднем Байкале. В составе консорциума идентифицированы водные грибы рода Phytium, археи, бактерии, в том числе метанотрофные, а также нематоды и остракоды. Высказано предположение, что мицелий водных грибов, прорастая внутрь битума, способствует перемещению внутрь микроорганизмов, использующих в качестве субстрата различные углеводороды, и таким образом, обеспечивает доступ кислорода в глубинные слои битума. Углеводородокисляющие бактерии, в свою очередь, могут служить пищей нематодам и другим организмам, обеспечивая их существование внутри битумных построек.
Исследования выполнены при поддержке проекта по Программе Президиума РАН 23.8.
ECOLOGICAL CRISYS IN THE COASTAL ZONE OF LAKE
BAIKAL
Timoshkin O.A., Malnik V.V., Sakirko M.V., Bondarenko N.A., Rozhkova N.A., Sheveleva N.G., Volkova E.A., Nepokrytykh A.V., Zaitseva E.P., Medvezhonkova O.V., Lukhnev A.G., Zvereva Yu.M., Poberezhnaya A.E., Shirokaya A.A., Potapskaya N.V., Tomberg I.V., Domysheva V.M., Timoshkina E.M., Kupchinsky A.B.
Limnological institute SB RAS, Irkutsk, Russia
tim@lin.irk.ru
Interdisciplinary research of Baikal coastal zone (splash zone including) has been performed within 2007-2014. Significant changes of the structure and quantitative characteristics of the shallow water benthonic communities were detected at the scale of the entire lake (Timoshkin et al., 2014 - most
References can be downloaded from www lin.irk.ru). During 2007-2012 it has been performed sporadically, in restricted areas of Bolshye Koty and Listvyanichny bays only, due to lack of financial support (Kravtsova et al., 2011; Timoshkin et al., 2014; Kravtsova et al., 2014). Methods and main results of the ecology of splash zone investigations were published in 13 papers (for review, see: Timoshkin et al., 2011). Taxonomic composition and quantitative characteristics of macrophyto-, macrozoobenthos, plankton communities, as well as hydrochemical, hydrological and microbiological parameters of the near-bottom and surface waters were investigated in the shallow water zone. Several round-Baikalian spring-summer and autumn expeditions were organized since 2013, due to initiative of acad. Grachev M.A.
When these processes started? Or - when they were expressed most remarkably? For lack of the regular round-Baikalian survey of the shallow water communities before 2010, one can provide only approximate answer, based on the limited research in South Baikal. Most probable starting point is 2010¬2011. Most significant changes detected in the macrophytobenthos communities. Conclusions on possible changes of the macrozoobenthonic communities (except for sponges, see below) can be made after on¬going quantitative sample analysis only. Chronology and brief characteristics of these unusual and/or negative ecological processes, which have been found within 2010-June 2015, are given below.
1. Two independent groups of experts (ob. cit.) reported on significant, large-scale modifications in composition and productivity of the dominant macroalgae, detected in 2010-2011, in two local South Baikal bays (Bolshye Koty and Listvyanichny). Mass development of non-typical for open Baikal green filamentous algae of Spirogyra genus (at 0.5-10 m depths) and abundant late autumn bloom of another filamentous algae Stygeoclonium tenue, in the shore line zone (first algal belt), which usually occupied by Ulothrix zonata filaments. Later on (2013-2014) Spirogyra mass blooming was detected in the shallow water zone at the scale of almost entire lake: Severobaikalsk and Nizhneangarsk cities; Onokochanskaya, Boguchanskaya, Senogda, Ludar’, Ayaya, Amnundakan, Davshe, Bargyzin (northern coast, off Maximikha, Rovesnik etc.) bays; Babushkin, Tankhoy, Baikalsk, Slyudyanka, Kultuk cities; old Baikalian railway, Listvyanichny, Obuteikha, Bolshye Koty, Bolshoe Goloustnoe, Peschanaya, Babushka bays. It means, that Spirogyra spp. massively developed and even dominated in the shallow water zone of the eastern, and in many areas of the western coasts. As distinct of comparatively shallow eastern coast with more or less homogeneous distribution, algal blooms along the western coast have been strictly concentrated opposite of the coastal settlements and the centers of recreation activity. Surprisingly enough, the development maximum of Spirogyra is detected during the autumn (September-October) with low water temperatures (4-8° C). Two areas (Listvyanichny Bay and Tyya-Senogda coast) of 15-20 investigated so far are characterized by all-the-year round mass bloom of Spirogyra spp. Drudge samplings, performed in Boguchanskaya Bay and opposite of Tyya River mouth (autumn 2013), evidenced, that the Spirogyra filaments are quite abundant till 10-20 m depth. Wet biomass of the alga varied within 100-1500 g/m2, what is compatible and even higher of the analogous indexes known for Baikalian algae of the 1-st and 2-nd algal belts. Late autumn Stygeoclonium mass bloom was typical for the 1-st algal belt in 2013, as well as in 2014 in many areas of all 3 basins.
2. Significant increase of the typical Baikalian macroalgae wet biomass (productivity) in the shallow water zone. For example, the algal biomass of the 1-st belt (with U. zonata dominating, June 2015) in some areas of North basin varied within 3-5 kg/m2, what is much higher of the analogous indexes known for the former times (Ижболдина, 1990: maximum in June - 0.5 kg/m2).
3. Mass development of the «saprophytic» (see below) and «free-living» blue-greens in several areas of the lake. Significant amount of the Oscillatoriales filaments have been found in the drudge benthonic samples, taken from 10-15 m southern of Peschanaya Bay, in summer of 2013 and 2014. Their mass blooming found as well in the shallows of Bolshye Koty, Barguzin bays, etc. (Phormidium, Oscillatoria, Tolypothrix spp. and others).
4. Giant coastal accumulations of rotten algae (Spirogyra, Elodea and other higher water plants, blue-greens, Cladophora glomerata etc.), wet biomass of which may exceed 90 kg/m2, detected within 2013-2014 at the first time. They are located in the splash zones of Tyya-Senogda beach, Chyvyrkuy (Monakhovo) and Barguzin (Maximikha, Rovesnik) bays, MRS, Shida Bay and Kultuk coast. Abundant coastal accumulations, mostly consisting of the “free-living blue-greens” (Tolypothrix spp., etc.) detected in Barguzin Bay at the first time. Giant algal accumulations on the coasts are typical for the late summer or autumn seasons. However, one of them (consisting of typical macroalgae of this area) was found unusually early - in June 2015, opposite of MRS settlement, at the first time. Evidently, seasonal maximum of the local algae development may occur earlier than before.
5. Mass Gastropoda extinction (mostly - representatives of Lymnaea genus) is described in 2013¬2014: billions of the died shells found on the sandy beaches between Tyya and Senogda. These “cemeteries” are located along the areas of the most abundant Spirogyra development and influenced by sewages from Severobaikalsk City. Less abundant Lymnaea shell accumulations found along the splash zone, off Maximikha settlement in Barguzin Bay (June 2015).
6. Mass extinction and several kinds of diseases of endemic Lubomirskiidae sponges at the scale of the entire lake were described in 2013-2014 (Тимошкин и др., 2014). All 3 ecological forms of the sponges (branched, encrusting, globular) can be sick. Over than 50 dives performed in 2014. Depending on area, from 30 to 100% of branched Lubomirskia baikalensis specimens were either sick or damaged and died. According to Dr. Ch. Boedecker (pers. comm.), in most of the studied areas of South basin (September 2014) this process was limited by isobaths 15-20 m. Deeply leaving sponges were found to be sick in June 2015.
It was described, that the most distributed sponge illness is accompanied by mass development of the “saprophytic” blue-greens of Phormidium genus (Тимошкин и др., 2014). The filaments are cherry- red and moving. Light-microscopic analysis evidences, that each affection patch on the sponge surface consists of 1-2 dominating blue-green species (90-95%). Different deformations and damage of the external sponge surface (=beginning stages of its extinction) in most cases (50-80%) happen prior to the mass blue-green development. According to preliminary data, the branched sponges, dwelling in the South Basin (Listvyanichny, Bolshye Koty Bays, off Chernaya River mouth) are most of all affected by illness. Much less damaged or even healthy L. baikalensis specimens were found around the north¬western coast area, approximately located between Elokhin Cape and Bolshye Olkhonskye Vorota Gate. Nota bene: the same coastal area has been found to be free of mass Spirogyra blooms in 2014.
7. High concentrations of the fecal indicating bacteria have been determined in the surface and near-the-bottom water layers along the coasts opposite the settlements. The same is true for the interstitial waters (especially - under the coastal accumulated algae) of the splash zone. For example, the enterococci concentrations may exceed 2000 colony forming units per 100 ml.
Results of 13-years long investigations evidencing on the large-scale, so-called "hidden" (or - indirect) eutrophication of the splash and the shallow water zones of Baikal (Timoshkin et al., 2014; Timoshkin, 2015). Huge amount of the pure waters and the active turbulence prevent the creation of the stable areas or patches with high nutrient concentrations in the water column (what is typical scenario of eutrophication in many shallower and smaller lakes). Extra nutrients entering Baikal coastal zone through the inlets (1) and, what is typical for most of the settlements without sewage purification system, through the coastal ground, by passive filtration (2). Therefore, the most illustrative ecological changes happen in the near shore zone and related to shallow water benthonic (bottom) rather than planktonic (water column) communities. According to preliminary data for 2012-2014, sewage of Severobaikalsk only contributed into the shallow waters of the north top of the lake up to 6 tons of P (PO4-) annually. It was the main reason of the most abundant Spirogyra bloom ever detected during all history of limnological research on Baikal. Total wet biomass of costal accumulated algae (95-97% of Spirogyra), detected along to 8 km of Tyya-Senogda beaches in autumn 2013, exceeding 1400 tons.
According to the senior author, the main reasons of the negative ecological processes described are as follows: a) long-lasting discharge of non-properly purified (or not purified at all) sewages into shallow water zone (Severobaikalsk, Babushkin, Baikalsk, Slyudyanka and other cities); b) destroyed purification stations, which were constructed during the USSR period (Ust-Barguzin) or their absence in the largest coastal cities and settlements, where the active construction of the hotels and recreation centers is taken; as a result -passive sewage filtration through the ground into the coastal zone; c) mass discharge of the sewage from the numerous ships and vessels. According to the world literature (for review, see Timoshkina, in press), mass Spirogyra bloom is often accompanying the areas with non-properly purified sewage discharge. Two other factors such as artificial water level fluctuations and climatic changes may be crucial for the mass development of the macrophytes. All the factors are detected in Baikal. However, to the mind of the senior author, climatic changes may only catalyze these processes, but barely can play the dominant role. Extra nutrient income should be considered as the most important factor of mass algal blooms.
All these negative phenomena observed in the lake for the past four years, have not been documented and are not reflected in the government reports on the state of the ecosystem of Lake Baikal in 2011-2014. This situation clearly shows the inefficiency of government monitoring system of Lake Baikal because it is almost exclusively concentrated on the survey of the central water body of the lake. Shallow water zone (and splash zone), which are the most indicative from the viewpoint of potential anthropogenic influence, are not included into the monitoring system. Therefore it is not in principle capable of diagnosing the possible destruction of the ecosystem bottom occurring due to the “hidden” eutrophication.
Investigations performed within the federal project № 01201353447 «Current condition, biodiversity and ecology of the coastal zone of Lake Baikal» and partly supported by RFBR project № 13-04-01270 and by director of the Institute, academician, Grachev M.A.
ЭКОЛОГИЧЕСКИЙ КРИЗИС В ПРИБРЕЖНОЙ ЗОНЕ ОЗЕРА
БАЙКАЛ
Тимошкин О.А., Мальник В.В., Сакирко М.В., Бондаренко Н.А., Рожкова Н.А., Шевелева Н.Г., Волкова Е.А, Непокрытых А.В., Зайцева Е.П., Медвежонкова О.В., Лухнев А.Г., Зверева Ю.М., Побережная А.Е,
Широкая А.А., Потапская Н.В., Томберг И.В., Домышева В.М., Тимошкина
Е.М., Купчинский А.Б.
Лимнологический институт СО РАН, г. Иркутск, Россия
tim@lin.irk.ru
Результаты междисциплинарных исследований прибрежной зоны Байкала (включая зону заплеска) за период 2007-2014 гг. свидетельствуют о значительных изменениях в структуре и количественных характеристиках мелководных сообществ дна в масштабах всего озера (Тимошкин и др., 2014). В 2007-2012 гг., из-за отсутствия финансирования, они проводились ограниченно, в районе заливов Большие Коты и Листвяничный (Кравцова и др., 2011; Тимошкин и др., 2014а; Kravtsova et al., 2014). Методы и основные результаты исследований экологии заплесковой зоны отражены в 13 публикациях (обзор: Тимошкин и др., 2011). В мелководной зоне изучались состав и количественные характеристики сообществ макрофито- и макрозообентоса, планктон, гидрохимические, гидрологические и микробиологические характеристики придонных, поверхностных слоев воды. Начиная с 2013 г., благодаря поддержке директора ЛИН СО РАН, М.А. Грачева, было организовано несколько весенне-летних и осенних экспедиций по всему озеру. В силу отсутствия регулярных кругобайкальских наблюдений до 2010 г., начало этих изменений можно датировать лишь примерно, по результатам исследований в Южном Байкале. Вероятная «точка отсчета» - 2010-2011 гг. Наиболее значимые перестройки произошли в сообществах макрофитобентоса. Выводы по возможным изменениям в сообществах зообентоса (кроме губок) возможны лишь после анализа отобранных проб. Ниже приведены хронология событий и краткая характеристика основных необычных и негативных экологических процессов, обнаруженных нами за период 2010 - июнь 2015 гг.
1. В 2010-2011 гг., двумя независимыми группами исследователей (ob. cit.) обнаружены крупномасштабные изменения в составе и продукционных характеристиках доминирующих макроводорослей мелководной зоны отдельных заливов Южной котловины (Большие Коты и Листвяничный). Это выражалось в массовом развитии ранее не свойственных Байкалу зеленых нитчатых водорослей рода Spirogyra (глубины 0.5 - 10 м) и необычайно массовому развитию в поздне-осенний период другой нитчатой водоросли - Stygeoclonium tenue, в зоне первого растительного пояса, обычно образуемого нитчаткой Ulothrix zonata. В 2013-2014 гг. массовое цветение спирогиры обнаружено в мелководной зоне практически в масштабах всего озера: Северобайкальск, Нижнеангарск, бухты Онокочанская, Богучанская, Сеногда, Лударь, Аяя, Амнундакан, Давше, Баргузинский залив (северное побережье, Максимиха, Ровесник), Бабушкин, Танхой, Байкальск, Слюдянка, Култук, КБЖД, Листвянка, Обутеиха, Бол. Коты, бух. Песчаная, Бабушка, Бол Голоустное. Следовательно, в осенний период виды рода Spirogyra в массе встречались или даже доминировали в мелководье практически всего восточного и многих участках западного побережья. На западном побережье Южн. котловины развитие водоросли четко ограничивалось мелководьем возле прибрежных населенных пунктов и центров рекреации. Пик развития спирогир Байкала приходится на осень (сентябрь-октябрь). Их массовая круглогодичная вегетация пока свойственна лишь двум из 15-20 изученных районов: зал. Листвяничный и мелководье Тыя-Сеногда. Результаты драгирования, проведенные в 2013 г. напротив устья р. Тыя и в губе Богучанской (Сев. Байкал) свидетельствуют о внедрении спирогиры в открытое озеро до глубин 10-20 м. Выяснено, что сырая биомасса спирогиры сопоставима или даже превышает аналогичные значения, характерные для байкальских макроводорослей 1 -го и даже 2-го растительных поясов. Массовое поздне-осеннее развитие стигеоклониума в приурезовых сообществах всех трех котловин наблюдалось как в 2013, так и в 2014 гг.
2. Увеличение сырой биомассы (продуктивности) байкальских макрофитов мелководья. Так, в июне 2015 г. биомасса в первом растительном поясе (с доминированием улотрикса) некоторых участков Сев. Байкала достигала 3-5 кг/м2, что многократно превышает максимальные значения прошлых лет (Ижболдина, 1990: июньский максимум не превышает 0,5 кг/м2).
3. Массовое развитие «сапрофитных» (см. ниже) и «свободноживущих» цианопрокариот в некоторых районах озера. Летом 2013-2014 гг. огромное количество осцилляториевых цианопрокариот обнаружено на гл. 10-15 м при драгировании южнее бух. Песчаной. Значительное развитие бентосных цианопрокариот наблюдалось также в мелководье губы Бол. Коты, Баргузинском заливе и др. (Phormidium, Oscillatoria, Tolypothrix spp. и др.).
4. В 2013-2014 гг. обнаружены гигантские береговые скопления (БСД) гниющих водорослей различного состава (спирогира, элодея, цианопрокариоты, Cladophora glomerata, высшие водные растения и др.), достигающие по сырому весу до 90 кг/м2. Столь массовые БСД обнаружены для озера впервые. Они приурочены к прибрежной зоне западнее г. Северобайкальска, Чивыркуйскому заливу (Монахово), южному побережью Баргузинского залива (Максимиха, Ровесник), МРС, бух. Шида и пос. Култук. В Баргузинском заливе впервые обнаружены значительные БСД с доминированием «свободноживущих» цианопрокариот (Tolypothrix spp. и др.). Гигантские БСД обычно развивались в поздне-летний, осенний периоды. Впервые для июня обнаружено гигантское БСД из байкальских макрофитов в районе МРС (2015). Следовательно, массовое их развитие в сезонном аспекте сдвигается на более ранние сроки.
5. В 2013-2014 гг. обнаружены настоящие кладбища брюхоногих моллюсков (в основном, лимнеид), сотни тысяч раковин выброшены на берег. Они приурочены к местам наиболее массового развития спирогиры, на северной оконечности озера (Сеногда-Заречный). В июне 2015 г. аналогичные, но не столь масштабные кладбища обнаружены напротив пос. Максимиха.
6. В 2013-2014 г., в масштабах мелководной зоны практически всего озера, выявлено поражение (гибель, несколько видов болезней) эндемичных байкальских губок - как корковых, глобульных, так и ветвистых. По результатам 50 погружений сентября 2014 г. выявлено, что от 30 до 100% особей Lubomirskia baikalensis были либо повреждены, либо больны. В 2014 г. это явление в большинстве изученных мест Южн. котловины ограничивалось глубинами 15-20 м (Boedecker, pers. comm.), в 2015 затрагивает более глубокие районы. Впервые выявлено, что наиболее распространенное заболевание губок сопряжено с массовым развитием «сапрофитных» цианопрокариот рода Phormidium (Тимошкин и др., 2014). Нити водорослей подвижны и окрашены в темно-вишневый цвет. Светооптический анализ показывает, что в пятне поражения на 90-95% доминируют цианопрокариоты, 2-3 вида. Различной степени деформация наружной поверхности губки (т.е. - начальные стадии ее отмирания) в большинстве исследованных случаев (50-80%) предшествует массовому заселению ее цианопрокариотами. По предварительным данным, наиболее поражены ветвистые губки Южной котловины (залив Листвяничный, напротив пади Черная и др.), наименее - губки северо-западного участка (примерно Елохин-Большие Ольхонские ворота). Этот же участок, в основном, свободен от спирогир.
7. Выявлены превышения норм СанПин в поверхностных и придонных водах пляжей большинства прибрежных населенных пунктов по санитарно-показательным микроорганизмам. Их значительные концентрации обнаружены также в поровых водах пляжей, особенно - в лунках под БСД. Так, количество энтерококков может превышать 2000 КОЕ/100 ml.
Результаты 13-летних исследований прибрежной зоны свидетельствуют о крупномасштабной «скрытой эвтрофикации» мелководной и заплесковой зон озера Байкал (Тимошкин и др., 2014; Timoshkin, 2015). При этом огромная масса чистой воды Байкала и ветро¬волновая активность препятствуют формированию стабильных повышенных концентраций биогенов в толще воды. Поэтому основные изменения происходят не в толще воды, что свойственно для большинства сравнительно мелководных озер, подвергшихся эвтрофированию, а на дне Байкала. Основными путями поступления излишних биогенов являются притоки, куда осуществляется сброс стоков и пассивная фильтрация последних сквозь грунт береговой зоны. По предварительным данным, только со стоками г. Северобайкальск в мелководную зону Сев. котловины за 2012-2014 гг. через р. Тыя поступало 6 тонн P(PO4-) ежегодно, что привело к наиболее массовому развитию спирогиры за всю историю наблюдений. Сырая биомасса только выброшенных на берег водорослей осенью 2013 г. достигала 1400 тонн.
По мнению первого автора, наиболее вероятными причинами этих негативных процессов являются: а) многолетний сброс в озеро Байкал недостаточно очищенных, либо - вовсе не очищенных сточных вод (города Северобайкальск, Бабушкин, Байкальск, Слюдянка); б) разрушение очистных сооружений, построенных во времена СССР, либо их полное отсутствие в наиболее крупных прибрежных населенных пунктах, в которых осуществлялось и продолжает осуществляться массовое строительство объектов отдыха и проживания; как следствие - в) пассивная фильтрация стоков сквозь береговую зону и/или их поступление с притоками (большинство прибрежных населенных пунктов), г) массовый сброс фекальных и подсланиевых вод с многочисленных судов.
По данным мировой литературы (обзор: см., Тимошкина, в печати), массовое развитие спирогиры зачастую свойственно водоемам, куда сбрасываются недостаточно очищенные сточные воды. Помимо биогенов, два других фактора могут играть решающую роль: искусственное колебание уровня воды и климатические изменения. Все три фактора свойственны и Байкалу. Однако, по мнению ТОА, климатические изменения могут лишь катализировать эти процессы, но главенствующей роли не играют. Поступление излишних биогенов следует рассматривать как основной фактор массового развития макрофитов в прибрежной зоне озера.
Очевидно, что существующие государственные системы мониторинга не эффективны, поскольку они сверх сконцентрированы на слежении за центральным водным телом озера, мониторинг мелководной зоны (включая заплесковую) в систему не включен. Т.е. - эта система потенциально не способна диагностировать возможные поражения экосистемы дна озера Байкал, которые могут происходить вследствие «скрытой эвтрофикации».
Работа выполнена в рамках госбюджетного проекта № 01201353447 «Современное состояние, биоразнообразие и экология прибрежной зоны озера Байкал» и частично поддержана грантом РФФИ № 13-04-01270 и директором Института академиком М.А. Грачевым.
UNEXPECTEDLY HIGH SPECIES DIVERSITY REVEALED IN AN ENDEMIC GASTROPOD GENUS (PARAMELANIA) FROM LAKE TANGANYIKA: THE COMPLEMENTARY ROLE OF OLD AND NEW
COLLECTIONS Todd J.A., Burgon J.D., Michel E. department of Earth Sciences, Natural History Museum, London, UK 2Institute of Biodiversity, Animal Health and Comparative Medicine,
University of Glasgow, UK
department of Life Sciences, Natural History Museum, London, UK
j .todd@nhm.ac.uk
Lake Tanganyika’s endemic ‘superflock’ of cerithioidean snails is perhaps the most diverse (>100 species) and morphologically disparate (18 genera) extant gastropod radiation within Ancient Lakes worldwide. Known generic diversity was discovered early and has grown little over the past century. Until now species diversity has been considered to be well known, excepting the single hyper-diverse genus, Lavigeria, One moderately diverse genus, the iconic Paramelania, has been known for 130 years and historically has been considered to comprise 2-5 morphologically variable species or ‘forms’; but it has long been recognised that the genus is in need of revision. We decided to undertake a detailed re¬examination based on the following materials:
-historic collections, 19th and early 20th century, Brussels (RBINS), London (NHM), Tervuren (MRAC) (mostly shells only): 321 lots, 6414 specimens
-A. Cohen research collection (shells): 69 lots, 1382 specimens
-E. Michel research collection (shells, EtOH specimens): 87 lots, 529 specimens
-Our aim was to answer the following questions:
1. Do finely divided shell-based groups (species) coincide with molecular clades based on sequencing COI and 16S gene fragments?
2. How do the species composition of historic and modern collections using a variety of methods (e.g. dredging, SCUBA) compare over 147 lake-wide collections?
3. Are within-site collections of living and dead (shell) specimens comparable?
We obtained DNA sequences (16S, COI) from specimens comprising five a priori, finely divided, shell-based species; robust molecular clades proved to be consistent with shell morphology. We used this correspondence to assess species diversity in the three major historic collections comprising shells only, including samples from the currently inaccessible Congo coast. We also re-assessed the two modern research collections (including radulae, opercula), largely from the Tanzanian coast, in the light of insights gained from historic samples.
The combined historic and modern collections comprised over 8395 shells from 147 lake-wide locations, with a marked difference in collection method, maximum depth and substrata between historic and modern collections. Geographic sampling was uneven, historically focused in Congo and Zambia, while modern samples were largely restricted to Burundi and Tanzania. Twenty-one species were separable using shell morphology (16 undescribed) - another two species are found in collections elsewhere. Historic and modern collections showed similar total diversity, 16 and 14 species respectively, but shared only 9 in common. High levels of sympatry were seen. Both wide-ranging species and short- ranged local endemics are present (n=7; undescribed) and evidence exists for extensive range shifts between dead and living populations.
Historic and modern collections give complementary views of diversity and distribution of Paramelania, capturing differences in geographic ranges and ecology. Unexpectedly high levels of ‘hidden’ diversity were found: 21 species, 16 undescribed. The value of fine-scale shell morphology in delimiting species within this genus was revealed here through strong molecular-morphological congruence. Our results emphasise that in systems with high local endemism, historic collections may contain undocumented diversity only revealed in a modern interpretive context. In such cases, species discovery needs to be undertaken on both modern and historical collections to get the most accurate view of biodiversity.
УДК 574.21
О. А. Тимошкин1, Н. А. Бондаренко1, Е. А. Волкова1, И. В. Томберг1, В. С. Вишняков1,2, В. В. Малъник1
МАССОВОЕ РАЗВИТИЕ ЗЕЛЕНЫХ НИТЧАТЫХ ВОДОРОСЛЕЙ РОДОВ SPIROGYRA И STIGEOCLONIUM (CHLOROPHYTA) В ПРИБРЕЖНОЙ ЗОНЕ ЮЖНОГО БАЙКАЛА*
В результате шестилетних (2008—2013 гг.) исследований макроводорослей прибрежной зоны западного берега южной котловины Байкала (исток р. Ангары — зал. Лиственничный, междисциплинарный полигон у м. Березового, бух. Боль¬шие Коты от р. Черной до пади Варначки) обнаружено, что на глубине от 0,3 до 3,0 м во второй половине лета — осенью доминируют виды р. Spirogyra Link, ра¬нее в озере не встречаемые. Изучение биологии водорослей в природной среде и в условиях культуры позволило идентифицировать один из доминирующих ви¬дов как S. fluviatilis Hilse. В зоне уреза бух. Большие Коты в ноябре 2012 г. впер¬вые в масштабе всей бухты отмечено массовое развитие другой нитчатой водо¬росли — Stigeoclonium tenue (C. Agardh) K"tz. Оценены масштабы продуцирова¬ния представителей р. Spirogyra в районе исследований. Показано, что в период максимального развития (ноябрь) водоросли могут создавать фитомассу до 317 ±143 г/м2 при 100%-ном проективном покрытии каменистого субстрата дна.
Ключевые слова: прибрежная зона, зеленые нитчатые водоросли, массо¬вое развитие, Spirogyra, Stigeoclonium tenue, оз. Байкал.
Макроводоросли являются важным компонентом первичного трофиче¬ского звена прибрежья озер и водохранилищ, они оказывают влияние на кислородный и биогенный режим, служат пищей и убежищем для беспозво¬ночных. Известно, что изменение трофического статуса водоемов (в том числе и в результате антропогенного воздействия) может приводить к мас¬совому развитию несвойственных им макроводорослей, смене аборигенных видов-доминантов или к нарушению естественной для экосистемы поясно¬сти в их распределении [15, 23, 31, 34]. Великие Американские озера являют¬ся классическим примером массового развития зеленых нитчатых водорос¬лей, связанного с увеличением биогенной нагрузки [16, 26—29, 38]. Берего¬вые скопления детрита, состоящие в основном из отмерших и перегниваю¬щих талломов водорослей, могут создавать серьезные проблемы. Известно,
* Работа выполнена в рамках госбюджетного проекта Сибирского отде¬ления РАН № VI.51.1.10 «Современное состояние, биоразнообразие и экология прибрежной зоны озера Байкал».
© О. А. Тимошкин, Н. А. Бондаренко, Е. А. Волкова, И. В. Томберг,
В. С. Вишняков, В. В. Мальник, 2014
ISSN 0375-8990 Гидробиол. журн. 2014. № 5. Т. 50
что эти процессы негативно сказываются на рекреационных свойствах во¬доемов, вода становится непригодной для использования в пищевых целях. Гниющие водоросли являются одной из основных причин так называемого вторичного загрязнения водоемов органическими веществами и тяжелыми металлами, при этом могут происходить массовые заморы донных живот¬ных и рыб [24, 35, 36]. Кроме того, гниющие водоросли являются субстратом для размножения патогенных организмов кишечной микрофлоры [21, 25].
Большое значение макроводорослей для функционирования прибреж¬ных сообществ оз. Байкал показано ранее [5, 6, 9]. Хорошо изучены их сис¬тематический состав, количественные параметры и особенности биологии [3, 5, 8, 11]. В годовой динамике развития донных макроводорослей озера выделяется летний максимум, когда кроме растущих круглый год видов, не имеющих ярко выраженных сезонных колебаний, в массе обнаруживаются водоросли с коротким периодом вегетации, дающие один пик биомассы. В это время четко выражены все пять известных для Байкала сменяющихся по вертикали растительных поясов [5, 8, 11]. Совсем недавно появились ра¬боты, свидетельствующие о нарушении зональности распределения макро¬водорослей озера. В частности, сообщается о замене в летний период 2011 г. в районе зал. Лиственничного эндемичных видов Draparnaldiodes, домини¬рующих в третьем растительном поясе, нитчатой водорослью Spirogyra sp. и о находке в 2012 г. большого количества спирогиры, прикрепленной к каме¬нистому субстрату этого залива на глубине 0,3—0,5 м (в составе I раститель¬ного пояса) [3, 7]. Ранее в открытом Байкале нити спирогиры практически не встречались [5]. Также упоминается массовое развитие зеленой водорос¬ли Stigeoclonium tenue (C. Agardh) Ktitz. поздней осенью 2011 г. в урезовой зоне пади Жилище (бух. Большие Коты) [3]. Эта водоросль в значительном количестве была обнаружена на камнях уреза и небольшей глубине в зал. Лиственничном. Массовое развитие стигеоклониума в урезовой зоне Байка¬ла при отсутствии обычного улотрикса до начала наших исследований не от¬мечалось. S. tenue встречается в Байкале вдоль северо-западного побережья южной котловины, в августе — сентябре — на каменистом субстрате на глу¬бине 1,0—2,5 м, в этот же период он обильно вегетирует в р. Большой Ко- тинке, впадающей в бух. Большие Коты [5].
Цель настоящей статьи — дать краткую характеристику новому для при¬брежья Байкала явлению — смене видов доминантов (на примере бух. Боль¬шие Коты и зал. Лиственничного), привести сведения по экологии предста¬вителей родов Spirogyra Link. и Stigeoclonium Ktitz., а также по идентифика¬ции доминирующих видов рода Spirogyra.
Материал и методика исследований**. В работе использованы материа¬лы, полученные в 2008—2013 гг. как по натурным наблюдениям, так и в условиях культур. Для сравнения приводятся результаты анализа проб, со¬бранных в 2003 г. в районе междисциплинарного полигона Березового на станциях трансект, расположенных над глубинами от 1,2 до 4,2 м. Пробы
** Помощь в отборе проб и организации экспедиций оказали сотрудни¬ки ЛИН СО РАН А. Г. Лухнев и Е. П. Зайцева. Авторы благодарны к. б. н. Л. С. Кравцовой за ценные советы и рекомендации.
хранятся в фонде лаборатории биологии водных беспозвоночных Лимнологического института СО РАН (ЛИН СО РАН).
Многолетние полевые исследования проводили у западного берега юж¬ной котловины озера, в бух. Большие Коты, от р. Черной до пади Варначки (4—5 км), на базе стационара ЛИН СО РАН, а также в истоке р. Ангары. Рас¬пределение макрофитов изучали на трансектах, расположенных перпенди¬кулярно линии берега. Стандартные трансекты, как правило, были длиной не менее 50—70 м и достигали свала глубин. Особенности вегетации макро¬водорослей обоих родов в пределах первых двух поясов растительности устанавливали на укороченных трансектах (10—20 м) до глубины 1,7—2,0 м. Отбор проб проводили при помощи аквалангистов либо с помощью камне¬щупов нескольких конструкций по заранее заданной схеме. Она включала: 1) видеопрофилирование трансекты, 2) отбор проб в пределах каждого поя¬са макрофитов, 3) макрофотографирование ландшафтов и участков дна в месте отбора проб с помощью учетной рамки площадью 0,25 м2 или масш¬табной линейки (для определения площади проективного покрытия) и 4) от¬бор количественных проб методом «stone-unit» [17] .
Для определения площади проективного покрытия не менее трех камней с обрастанием, взятых с каждой глубины и места, фотографировали, испо¬льзуя масштабную линейку. Площадь определяли по макрофотографиям с использованием оригинальной программы Sponge area***. Применение это¬го метода на других группах гидробионтов, его описание и последователь¬ность компьютерной обработки фотографий приведены ранее [33].
Биомассу измеряли на весах Iuchi Sefi (IB-200H) (Япония) и Adventurer Ohaus AR 2140 (Китай). Обрастание с камней счищали скальпелем, тщатель¬но промывали в воде и отделяли от примесей. Перед взвешиванием излишек воды удаляли фильтровальной бумагой. Для определения сухой массы водо¬росли высушивали в сушильном шкафу при температуре 1050С в течение трех часов.
Для расчета частоты встречаемости водорослей готовили временные прижизненные препараты с двух-трех точек поверхности каждого камня («стоун-юнита»). Конкретному месту и дате отбора соответствовало 25—30 микрофотографий, выполненных при увеличениях, достаточных для опре¬деления видовой или родовой принадлежности макроводорослей (от х200 до х400). Микрофотографию условно приравнивали к отдельной пробе, в ней отмечали присутствие или отсутствие интересующих водорослей. Для неко¬торых проб (микрофотографий) просчитывали количество попавших в кадр нитей спирогиры или стигеоклониума, находили их относительное содержа¬ние (% общего количества макроводорослей в кадре). Микрофотографии получены с использованием световых микроскопов Olympus CX 21 и Meiji Techno при увеличении от х40 до х400, фотоаппаратов Olympus C-3040 с фо¬тонасадкой NY 2000S 01705 и SONY Cyber-shot. Всего проанализировано 135 проб и более 2000 микрофотографий.
*** Разработчик программы К. П. Букшук.
Культивировали водоросли в чашках Петри при естественном освеще¬нии и комнатной температуре на подоконнике лабораторной комнаты с се¬верной стороны здания. Сначала их помещали в чашки с озерной водой, за¬тем постепенно добавляли питательную среду Z-8 [30], имеющую активную реакцию (рН) соответствующую таковой исходной воды. Такие смешанные культуры в дальнейшем служили для изучения жизненного цикла водоросли и ее идентификации.
Для гидрохимического анализа воды отбирали два вида проб: поверхно¬стные и придонные, последние — при помощи аквалангистов либо вручную, двумя шприцами, объемом 300 мл каждый, закрепленными на шесте длиной 1,5—2 м. Анализ выполнен общепринятыми в химии пресных вод методами [10, 12]. Предварительно пробы фильтровали от взвеси через мембранные (поликарбонатные) фильтры с диаметром пор 0,45 мкм.
Результаты исследований и их обсуждение
В 2009 г. при исследовании донных альгоценозов в бух. Большие Коты и ее притоках в незначительном количестве были найдены водоросли р. Spiro- gyra. В дальнейшем они были идентифицированны как S. varians (Hass.) Ktitz. (рис. 1, г, g, е), которая развивается в реках Большой Котинке и Чер¬ной, и S. porticalis (O. Mtill.) Cleve, обитающая в районе устья р. Малой Ко- тинки. В р. Жилище также регистрировались стерильные нити спирогиры, морфологически близкие к S. varians из рек Черной и Большой Котинки.
В летне-осенний период 2011—2012 гг. по всему мелководью бух. Боль¬шие Коты, где расположен одноименный поселок, уже наблюдали массовую вегетацию чужеродных для озера водорослей р. Spirogyra. Они начинали ин¬тенсивно развиваться летом при температуре воды выше 10°С, достигая максимальной биомассы в ноябре при температуре воды около 4°С. В зим¬ний период (t ~ 0°С) в прибрежье также отмечались незначительные скопле¬ния спирогиры. Аналогичная картина наблюдалась и в мелководной зоне зал. Лиственничного в период открытой воды 2012 г. Биомасса этих водорос¬лей в осенний период сопоставима с максимальными значениями (210 г/м2) обычного обитателя урезовой зоны озера U. zonata в его летний пик разви¬тия (табл. 1).
При изучении жизненного цикла водорослей в условиях культуры было обнаружено, что по всему побережью доминировал ранее не зарегистриро¬ванный в озере вид Spirogyra fluviatilis Hilse [37] (см. рис. 1, ж, з, и). Он также не был встречен ни в одном из притоков бух. Большие Коты.
Как известно, S. fluviatilis — широко распространенная водоросль, оби¬тающая в теплый период года в озерах, реках и ручьях [18, 32]. Часто массо¬вое развитие представителей р. Spirogyra ухудшает качество воды [1, 14 и др.]. Например, увеличение обилия нитчатых водорослей родов Spirogyra и Zygnema Ag. в литорали оз. Конесус (Conesus Lake, США) привело к измене¬нию экологического статуса этой зоны и может оказать каскадный эффект на экосистему озера в целом [14]. Авторы связывают это явление с контро-
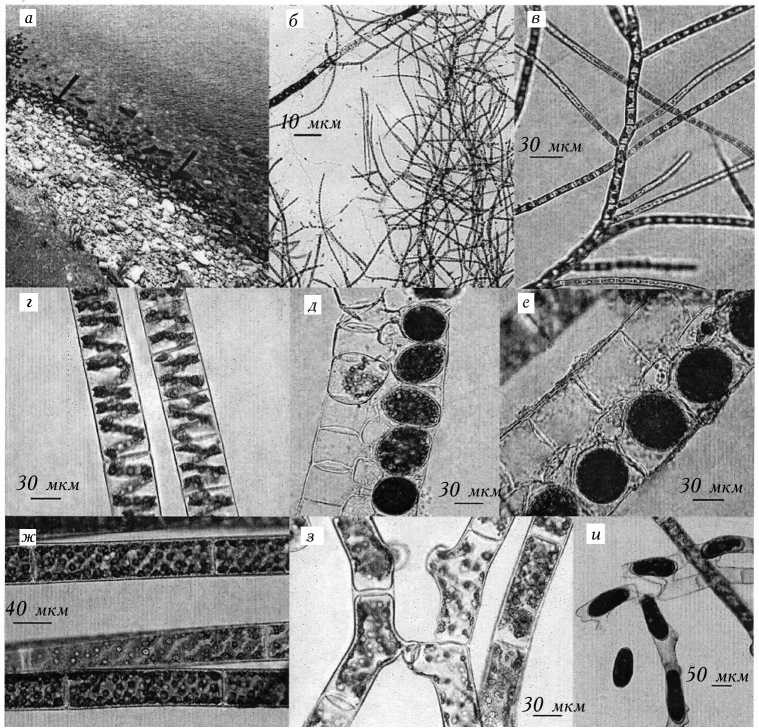
1. Фото прибрежья озера и микрофотографии водорослей: а — пояс Stigeoclonium tenue (стрелки) в прибрежье оз. Байкал, бух. Большие Коты; б, е — S. tenue, х100, х400; г, д — Spirogyra varians из р. Бо¬льшой Котинки: вегетативные нити (г), коньюгация с зигоспорами (д), х400; е — S. varians из р. Чер¬ной: коньюгация с зигоспорами, х400; ж, з, и — S.fluviatilis из бух. Большие Коты: вегетативные нити (ж), коньюгирующие нити (з), х400, коньюгация с зигоспорами (и), х100.
лируемой гидрометеорологическими событиями водностью притоков, при¬вносящих значительное количество растворимых форм фосфора и азота.
Показано, что S. fluviatilis интенсивно развивается летом в водах, бога¬тых азотом и фосфором. При этом важным фактором для успешного по¬требления питательных элементов водорослями и интенсивности их фото¬синтеза является умеренная скорость течения (от 12 до 15 см/сек) [18, 19].
Стерильные нити спирогиры в оз. Байкал отмечены многими авторами [5, 6, 8 и др.], однако ее массовое развитие ранее никогда не регистрирова¬лось. Недостаток регулярных исследований донных макроводорослей за по¬следние 15 лет не позволяет точно установить начало обсуждаемого явле¬ния. В связи с этим был проведен анализ проб, отобранных в 2003 г. Обнару-
1. Площадь проективного покрытия и масса S. fluviatilis (осень 2012 г.)

жено, что в составе макроводорослей встечались лишь единичные стериль¬ные нити р. Spirogyra. В истоке р. Ангары (возле пирса Байкальского музея в пос. Листвянке) постоянное присутствие небольшого количества этих водо¬рослей мы регистрировали с 2008 г. Все это свидетельствует о том, что раз¬витие представителей р. Spirogyra в литорали оз. Байкал приобрело массо¬вый характер лишь за последние несколько лет.
Еще одна нехарактерная для макрофитов Байкала особенность распре¬деления была обнаружена в ноябре 2011 г. в пади Жилище (бух. Большие Коты). Большинство камней, расположенных в зоне уреза, были на 100% по¬крыты ярко-зеленым обрастанием [3]. Внешне эта зона ничем не отличалась от типичного для открытого Байкала 1-го пояса, состоящего из U. zonata (см. рис. 1, а). Микроскопический анализ показал, что обрастание представляет собой нити зеленой водоросли, определенной как Stigeoclonium tenue (см. рис. 1, б, в).
В ноябре 2012 г. аналогичные работы проводились в Южном Байкале, в том числе бух. Большие Коты в районе р. Черной до падей Варначки и Сен¬ной. Микроскопическое исследование камней, расположенных в зоне уреза показало, что обрастание на 90—100% состояло из нитчатых водорослей р. Stigeoclonium и на 10% и менее — из Ulothrix. Средняя сырая биомасса пер¬вого составляла 322 ± 58 г/м2. Пробы, взятые в урезовой зоне пади Жилище бух. Большие Коты в 2013 г., также содержали значительное количество ни¬тей стигеоклониума.
Таким образом, можно сделать вывод о смене доминирующего вида пер¬вого растительного пояса открытого Байкала, происходящей поздней осе¬нью, как минимум в пределах целой бухты в период 2011—2013 гг. Массо¬вые находки стигеоклониума в пробах из урезовой зоны зал. Лиственнично¬го, а также его значительное количество в летне-осенних сборах 2013 г. в урезовой зоне западного побережья Малого Моря и северной оконечности Байкала (участок между городами Северобайкальском и Нижнеангарском) значительно расширяют масштабы этого нового для Байкала явления.

2. Подводная фотосъемка и микрофотографии донных водорослей: а — массовое развитие спирогиры на каменистом субстрате в бух. Большие Коты, ноябрь 2012 г., глубина 1,0—1,5 м; бе — примеры мик¬рофотографий с разным относительным обилием водорослей на препаратах: б — нитчатые водоросли рода Spirogyrac — смешанные обрастания: 1 — Ulothrixzonata; 2 — Spirogyra sp.; 3—Fragilaria sp.
Что же вызвало сложившуюся ситуацию в Байкале? Один из вариантов ответа в отношении стигеоклониума может быть весьма прост: маловероят¬но, но возможно, что предыдущими исследованиями не охватывался позд¬не-осенний период. Также не исключено, что эти водоросли просто прини¬мались за улотрикс — ведь без микроскопического исследования оба типа обрастания практически неразличимы.
Возможные причины массового развития несвойственных для озера ви¬дов легче всего свести к антропогенному фактору. Авторы [7], наблюдавшие такое явление в районе пос. Листвянка (зал. Лиственничный), связали его с возрастанием биогенной нагрузки на прибрежную зону в результате увели¬чения потока туристов. Но, как следует из гидрохимических исследований, ни в районе м. Березового, ни в бух. Большие Коты не отмечено значитель¬ных изменений в биогенной нагрузке по сравнению с таковой в 1950-е и 1960-е годы, служащие фоновыми для дальнейших исследований [4, 13].
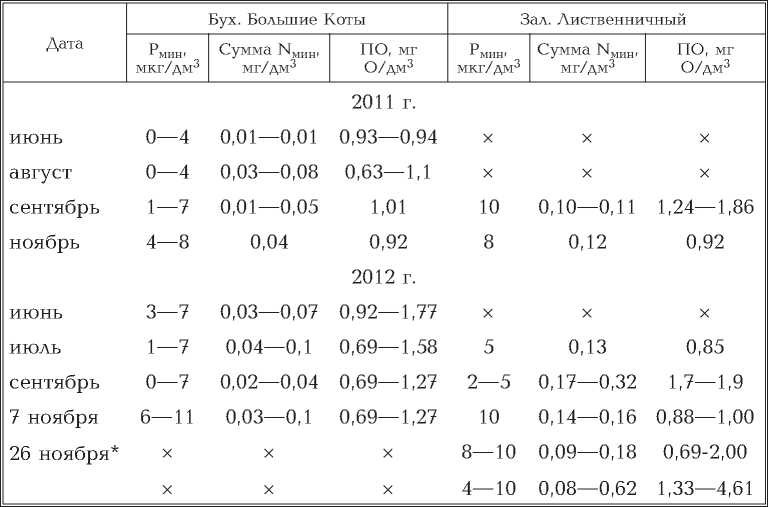
2. Концентрация химических компонентов в прибрежной воде (1 м от берега) зал. Лиственничного и бух. Большие Коты
Примечание. ПО — перманганатная окисляемость; х — исследования не проводили; * от¬бор придонных проб воды шприцами вблизи камней с обрастаниями.
Было показано, что содержание фосфатного фосфора в прибрежных водах озера и в 100 м от уреза было невысоким — 1—6 мкг/дм3 [13] и только в воде зал. Лиственничного оно возрастало до 10,5 мкг P/дм3
Наше исследование химии воды показало, что концентрация минераль¬ного фосфора в прибрежной воде в бух. Большие Коты в летние месяцы снижалась до нулевых значений, а осенью достигала максимальных — 11 мкг P/дм3 (табл. 2).
В прибрежной воде зал. Лиственничного концентрация фосфатов летом не опускалась ниже 2 мкг P/дм3, а осенью не превышала 10 мкг P/дм3, со¬держание минерального азота было в 2—8 раза выше, чем в бухте. В первом случае 70—95% суммарного количества составлял нитратный азот, во вто¬ром эта форма преобладала только в летние месяцы. В начале июня и сен¬тябре — ноябре в прибрежной воде бух. Большие Коты доля аммонийного увеличивалась до 60% общего содержания минерального азота. Содержание органических веществ в прибрежной воде заливов в летне-осенний период не превышало 2 мг О/дм3 (по ПО). Однако осенью, при отмирании и разло¬жении макроводорослей, в придонной воде (пробы, отобранные шприцами) этот показатель возрастал до 4,6 мг О/дм3, а содержание минерального азо¬та — до 0,62 мг N/дм3.
У западного берега от бух. Песчаной до зал. Лиственничного существуют области с устойчивыми течениями. Подо льдом скорость достигает 9—10 см/сек, в период открытой воды она на порядок выше [2], то есть пре¬вышает оптимальные (от 12 до 15 см/сек) для успешного роста водорослей. Тем не менее в Южном Байкале отмечена интенсивная вегетация S. fluviati- lis. В заливах влияние циклонических течений выражено слабее, спирогиры развиваются в прибрежной полосе шириной 20—30 м.
На современном этапе оценить причины ситуации, сложившейся в лито¬рали озера Байкал, и дать прогноз непросто. Можно предположить две основные причины массового развития чужеродных для озера нитчатых во¬дорослей. Во-первых, это может быть следствием естественной циклично¬сти в их развитии под воздействием глобальных факторов, например клима¬тических. Во-вторых, массовое развитие спирогиры зачастую приурочено к местам повышенной концентрации биогенных элементов, обусловленной, в частности, сбросом недостаточно очищенных сточных вод [20, 22]. Населен¬ные пункты, располагающиеся в прибрежной зоне оз. Байкал, как правило, не имеют централизованной системы очистки бытовых сточных вод. Коли¬чество частных гостиниц и туристов за последние годы выросло в несколько раз. Грунты надводной и заплесковой зон являются своеобразным буфером, фильтром, защищающим чистоту озер, однако их фильтрационная способ¬ность явно ограничена. В зал. Лиственничном предел этой способности, по-видимому, уже превышен. По нашим данным, в поровых водах зоны за- плеска, а также в пробах придонной воды на мелководье бух. Большие Коты и зал. Лиственничного в летний период 2010—2013 гг. регулярно обнаружи¬вались следы фекального загрязнения, обусловленного прежде всего пас¬сивной фильтрацией сточных вод прибрежных поселков. Например, в нояб¬ре 2012 г. количество термотолерантных колиформных бактерий (ТКБ) и эн¬терококков в пос. Листвянка, в лунке, выкопанной на пляже, было очень вы¬соким (соответственно 15 000 и 3700 КОЕ/100 мл). Значительное количество общих колиформных бактерий, ТКБ и энтерококков в это же время было обнаружено и в пробах придонной воды, взятых шприцами: соответственно 210, 80 и 66 КОЕ/100 мл.
Заключение
Многолетние (2003, 2008—2013 гг.) исследования структуры и количествен¬ных характеристик макроводорослей прибрежной зоны западного берега юж¬ной котловины Байкала показали, что на глубинах от 0,3 до 3,0 м (и более) во вто¬рой половине лета — осенью доминируют не отмечаемые ранее в озере виды р. Spirogyra. Изучение биологии водорослей в природной среде и в условиях куль¬туры позволило идентифицировать один из доминирующих видов как S. fluviatilis Hilse. Этот вид приводится для флоры озера впервые и пока в притоках исследуе¬мого района не обнаружен. В период максимального развития (ноябрь) биомас¬са водорослей может достигать 317 ± 143 г/м2 при 100%-ном проективном по¬крытии каменистого субстрата дна. В зоне уреза бух. Большие Коты и зал. Лист¬венничного отмечено массовое развитие и другой нитчатой водоросли — Stige- oclonium tenue (C. Agardh) Kitz., которая ранее встречалась в озере на глубине 1—2,5 м, а в заметном количестве развивалась только в р. Большой Котинке. Осенью при отмирании и разложении макроводорослей в придонной воде происходит значительное увеличение содержания органических веществ (в 2,0—2,5 раза). Полученные результаты, наряду с литературными сведениями, свидетельствуют о начале евтрофикации участков прибрежной зоны Байкала, приуроченных к ряду населенных пунктов.
**
**
Paper deals with unusual mass vegetation of filamentous microalga of the gen. Spirogy¬ra and Stigeoclonium tenue in late summer — autumn in the coastal zone of the southern section of Lake Baikal over the years 2008—2013. Probable reasons of this phenomenon are discussed.
**
1. Baccep С.П., Кондратьева H.B., Масюк Н.П. и др. Водоросли. Справоч¬ник. — Киев: Наук. думка, 1989. — 605 с.
2. Верболов В.И. Течения и водообмен в Байкале // Вод. ресурсы. — 1996.
— Т. 23, № 4. — С. 413—423.
3. Вишняков В.С., Тимошкин О.А., Ижболдина Л.А., Волкова Е.А. Таксономи¬ческий список макроводорослей прибрежной зоны бухты Большие Коты и залива Лиственничный (Южный Байкал) // Изв. Иркут. ун-та. Сер. Биология. Экология. — 2012. — Т. 5, № 3. — С. 147—159.
4. Голобокова Л.П., Сакирко М.В., Онищук Н.А. и др. Гидрохимическая ха-рактеристика вод литорали северо-западного участка Южного Байкала // Аннотированный список фауны озера Байкал и его водосборного бас¬сейна. — Новосибирск: Наука, 2009. — Т. 2: Водоемы и водотоки юга Восточной Сибири и Северной Монголии. Справочники и определители по фауне и флоре озера Байкал. — С. 760—784.
5. Ижболдина Л.А. Атлас и определитель водорослей бентоса и перифитона озера Байкал (мейо- и макрофиты) с краткими очерками по их экологии.
— Новосибирск: Наука-центр, 2007. — 248 с.
6. Кожов М.М. О видообразовании в озере Байкал // Бюл. МОИП. Отд. биол. — 1960. — Т. 65, № 6. — С. 39—47.
7. Кравцова Л.С., Ижболдина Л.А., Ханаев И.В. и др. Нарушение вертикаль¬ной зональности зеленых водорослей в прибрежной части залива Лист¬венничный озера Байкал // Докл. РАН. — 2012. — Т. 447, № 2. — С. 227—229.
8. Мейер К.И. Введение во флору водорослей оз. Байкал // Бюл. МОИП. — 1930. — Т. 39, № 3—4. — С. 179—392.
9. Окунева Г.Л. Сезонные изменения мезобентоса на каменистой литорали (район пос. Большие Коты) // Продуктивность Байкала и антропоген¬ные изменения его природы. — Иркутск: Изд-во Иркут. ун-та, 1974. — С. 137—152.
10. Руководство по химическому анализу поверхностных вод суши. Ч. 1 / Под ред. Л. В. Боевой. — Ростов н/Д: НОК, 2009. — 1044 с.
11. Скабичевский А.П. О распределении донной растительности Байкала в окрестностях Больших Котов // Бюл. МОИП. Отд. биол. — 1966. — Т. 71, № 6. — С. 108—119.
12. Строганов Н.С., Бузинова Н.С. Практическое руководство по гидрохи¬мии. — М.: Изд-во Моск. ун-та, 1980. — 193 с.
13. Томберг И.В., Сакирко М.В., Домышева В.М. и др. Первые сведения о хи¬мическом составе интерстициальных вод заплесковой зоны озера Бай¬кал // Изв. Иркут. ун-та. Сер. Биология. Экология. — 2012. — Т. 5, № 3.
— С. 64—74.
14. D'Aiuto Peter E. The impact of stream nutrient loading on metaphyton in Co- nesus Lake and the use of metaphyton incubation chambers for measurement in situ of changes in biomass // Environ. Sci. Biol. Theses. — 2002. — Paper 1. http://digitalcommons.brockport.edu/env_theses/1.
15. Anderson D.M., Glibert P.M., Burkholder J.M. Harmful algal blooms and eut-rophication: Nutrient sources, composition and consequences // Estuaries.
— 2000. — N 25. — Р. 704—726.
16. Barbiero R.P., Tuchman M.L. Long-term dreissenid impacts on water clarity in Lake Erie // J. Gr. Lakes Res. — 2004. — Vol. 30, N 4. — P. 2111—2125.
17. Biodiversity research methods // Ed. by T. Nakashizuka, N. Stork. — Kyoto: Kyoto University Press and Trans Pacific Press, 2002. — 216 р.
18. Borchardt M.A. Effects of flowing water on nitrogen- and phosphorus-limited photosynthesis and optimum N : P ratios by Spirogyra fluviatilis (Charophy- ceae) // J. Phycol. — 1994. — Vol. 30, N 3. — Р. 418—430.
19. Borchardt M.A., Hoffmann J.P., Cook P.W. Phosphorus uptake kinetics of Spi¬rogyra fluviatilis (Charophyceae) in flowing water // Ibid. — 1994. — Vol. 30, N 3. — Р. 403—417.
20. Bruun K. Algae can function as indicators of water pollution. The Washing¬ton State Lake Protection Association Newsletter, Waterline. — 2012. http://www.walpa.org.
21. Byappanahalli M.N. Whitman R.L. Clostridium botulinum type E occurs and grows in the alga Cladophora glomerata // Can. J. Fish. Aquat. Sci. — 2009.
— Vol. 66, N 6. — P. 879—882.
22. Derlet R.W., Richards J.R., Tanaka L.L. et al. Impact of summer cattle grazing on the Sierra Nevada watershed: aquatic algae and bacteria // J. Environ. Pub. Health. — 2012. — www:hindaws.com/jornals/jeph/N 760108.
23. Duarte C.M. Submerged aquatic vegetation in relation to different nutrient regimes // Ophelia. — 1995. — Vol. 41. — Р. 87—112.
24. Gubelit Yu.I., Berezina N.A. Coastal eutrophication phenomena in the Eastern Gulf of Finland // Conf. Proc. US/EU, Baltic Intern. Symp. — Tallinn, 2008.
— P. 1—4.
25. Gubelit Yu.I., Vainshtein M.B. Growth of enterobacteria on algal mats in the eastern part of the Gulf of Finland // Inland Water Biol. — 2011. — Vol. 4, N 2. — P. 132—136.
26. Higgins S.N., Howell E.T., HeckyR.E. et al. An ecological review of Cladopho¬ra glomerata (Chlorophyta) in the Laurentian Great Lake // J. Phycol. — 2008. — Vol. 44. — Р. 839—854.
27. Malkin S.Y., Guildford S.J., Hecky R.E. Modeling the growth response of Cla- dophora in a Laurentian Great Lake to the exotic invader Dreissena and to lake warming // Limnol. Oceanogr. — 2008. — Vol. 53, N 3. — P. 1111—1124.
28. Malkin S.Y., Sorichetti R., Wiklund J., Hecky R.E. Seasonal abundance, com¬munity composition, and silicon concentration of diatoms epiphytic on Cla- dophora glomerata // J. Gr. Lakes Res. — 2009. — Vol. 35, N 3. — P. 199—205.
29. Olapade O.A., Depas M.M., Jensen E.T., McLellan S.L. Microbial communities and fecal indicator bacteria associated with Cladophora mats on beach sites along Lake Michigan shores // Appl. Environ. Microbiol. — 2006. — Vol. 72.
— P. 1932—1938.
30. Rippka R. Recognition and identification of cyanobacteria // Methods Enzy- mol. — 1988. — Vol. 167. — P. 28—67.
31. Shao H.B., Cui B.S., Bai J.H. Outlook: Wetland ecology in China // Clean — Soil, Air Water. — 2012. — N 40. — P. 1011—1014.
32. Saygideger S. Bioaccumulation and toxicity of zinc in Spirogira fluviatilis Hil- se (Chlorophyta) // Water, air, soil pollut. — 1998. — Vol. 101, N 1—4. — P. 323—331.
33. Timoshkin O.A., Suturin A.N., Maximova N.V. et al. Rock preferences and microdistribution peculiarities of Porifera and Gastropoda in the shallow lit¬toral zone of Lake Baikal (East Siberia) as evidenced by underwater macro¬photograph analysis // Berl. Palaeobiologische Abhandlungen. — 2003. — Vol. 1. — P. 193—200.
34. Valiela I., McClellan J., Hauxwell J. et al. Macroalgal blooms in shallow estu¬aries: controls and ecophysiological and ecosystem consequences // Limnol. Oceanogr. — 1997. — N 42. — P. 1105—1118.
35. Vershinin A., KamnevA. Cladophora blooms at Anapa beaches (Black Sea) — result of anthropogenic eutrophication // Phycologia. — 2001. — Vol. 40, N 4. — P. 45.
36. Vershinin A., Kamnev A. Harmful algae in Russian European coastal waters // Harmful algal blooms 2000. Proc. 9-th Intern. Conf. on Harmful Algal Blo¬oms. — UNESCO, 2001. — P. 112—115.
37. Volkova V., Bondarenko N., Tomberg I., Timoshkin O. Intensive growth of Spi- rogyra fluviatilis Hilse (Streptophyta): structural changes in the benthic flora of lake Baikal coastal zone, East Siberia // ECSA 53: «Estuaries and Coastal Areas in Times of Intense Change», 13—17 Oct. 2013. — 2013. (12459).
38. Whitman R. L., Shively D.A., Pawlik H. et al. Occurrence of Escherichia coli and Enterococci in Cladophora (Chlorophyta) in nearshore water and beach sand of Lake Michigan // Appl. Env. Microbiology. — 2003. — Vol. 69, N 8.
— P. 4714—4719.
1 Лимнологический институт СО РАН, Иркутск, РФ
2 Институт биологии внутренних вод, Борок, РФ Поступила 23.06.14
Страницы:
- 1
